北京锦篮基因科技有限公司(以下简称“锦篮基因”)自主研发的国内第一款AAV鞘内给药治疗1型SMA基因药物,GC101腺相关病毒注射液注册临床试验通过第一阶段安全性评估,正在开展II期注册临床试验患者招募。
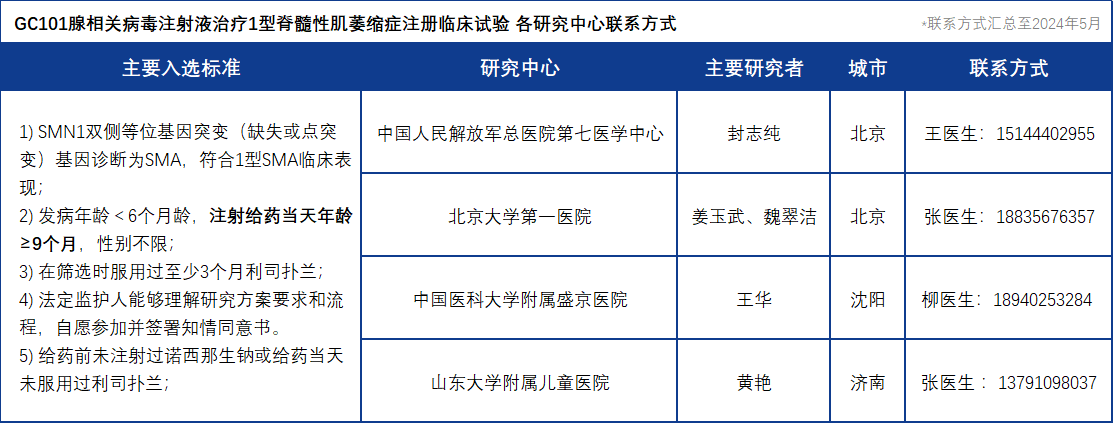
本次II期注册临床试验组长单位由中国人民解放军总医院第七医学中心担任,并将在北京大学第一医院、中国医科大学附属盛京医院、山东大学附属儿童医院等多中心招募24-30名符合条件的1型SMA受试患儿,详见下方表格:
GC101治疗SMA临床试验显示安全性良好
GC101注射液IND注册临床试验已在中国人民解放军总医院第七医学中心、北京大学第一医院、中国医科大学附属盛京医院、山东大学附属儿童医院、华中科技大学同济医学院附属武汉儿童医院等多个研究中心启动,研究目前共有11例1型SMA患者、29例2型SMA患者接受了GC101注射液一次性基因治疗。现有数据展现出GC101注射液良好的安全性和初步有效性,已接受治疗的小患者们在运动能力方面也展现出不同程度的提升。

3型SMA注册临床试验招募信息敬请关注
2024年05月06日,GC101注射液治疗3型SMA的注册临床试验(受理号CXSL2300035)已获组长单位首都医科大学附属北京天坛医院内伦理委员会批准,将在近期首先由组长单位牵头开展受试者招募,敬请关注后续信息发布。
关于脊髓性肌萎缩症
脊髓性肌萎缩症是由于运动神经元存活基因1(SMN1)突变导致 SMN 蛋白功能缺陷所致的遗传性神经肌肉病,是造成婴幼儿死亡的常染色体隐性遗传疾病之一,其致病基因在中国人群中的携带频率约为1/42,新生儿中发病率约为1/10000。1型SMA在出生时或出生数天内出现明显肌无力。 至6月龄时症状相当明显。 肌张力和反射减弱的患儿存在吸吮、吞咽及呼吸困难。2型SMA患者大部分在青少年时期会丧失独坐能力并瘫痪,患者往往死于呼吸衰竭等并发症;3型SMA患者受长期用药、逐步丧失运动能力等因素影响正常生活。在SMA疾病分型中,1型SMA患儿最为严重,如果没有得到及时有效治疗干预的情况下,中位生存期是13.6个月,绝大多数不超过24个月,是婴幼儿头号致死性遗传病。
关于GC101腺相关病毒注射液
GC101腺相关病毒注射液是一种携带正常SMN1基因表达单元的重组9型腺相关病毒载体(rAAV9),通过鞘内注射方式一次性给药,使SMN1基因在运动神经元细胞表达,从而改善运动神经元等受累细胞的功能,辅以呼吸及运动康复训练,可以改善提高SMA患者呼吸能力及运动能力。
关于锦篮基因
北京锦篮基因科技有限公司是一家以AAV载体递送技术介导的基因治疗药物开发为核心业务的国家高新技术企业,以推动中国罕见病基因药物从基础走向临床和市场为使命,造福患者及家庭。公司专注于遗传性神经肌肉疾病、遗传代谢疾病、溶酶体疾病以及眼科疾病等领域基因治疗药物开发,并通过推进罕见病基因药物研发和临床应用,更深入认识生命健康,将基因治疗技术及产品从罕见病过渡到慢性病和其它重大疾病的治疗和康复



