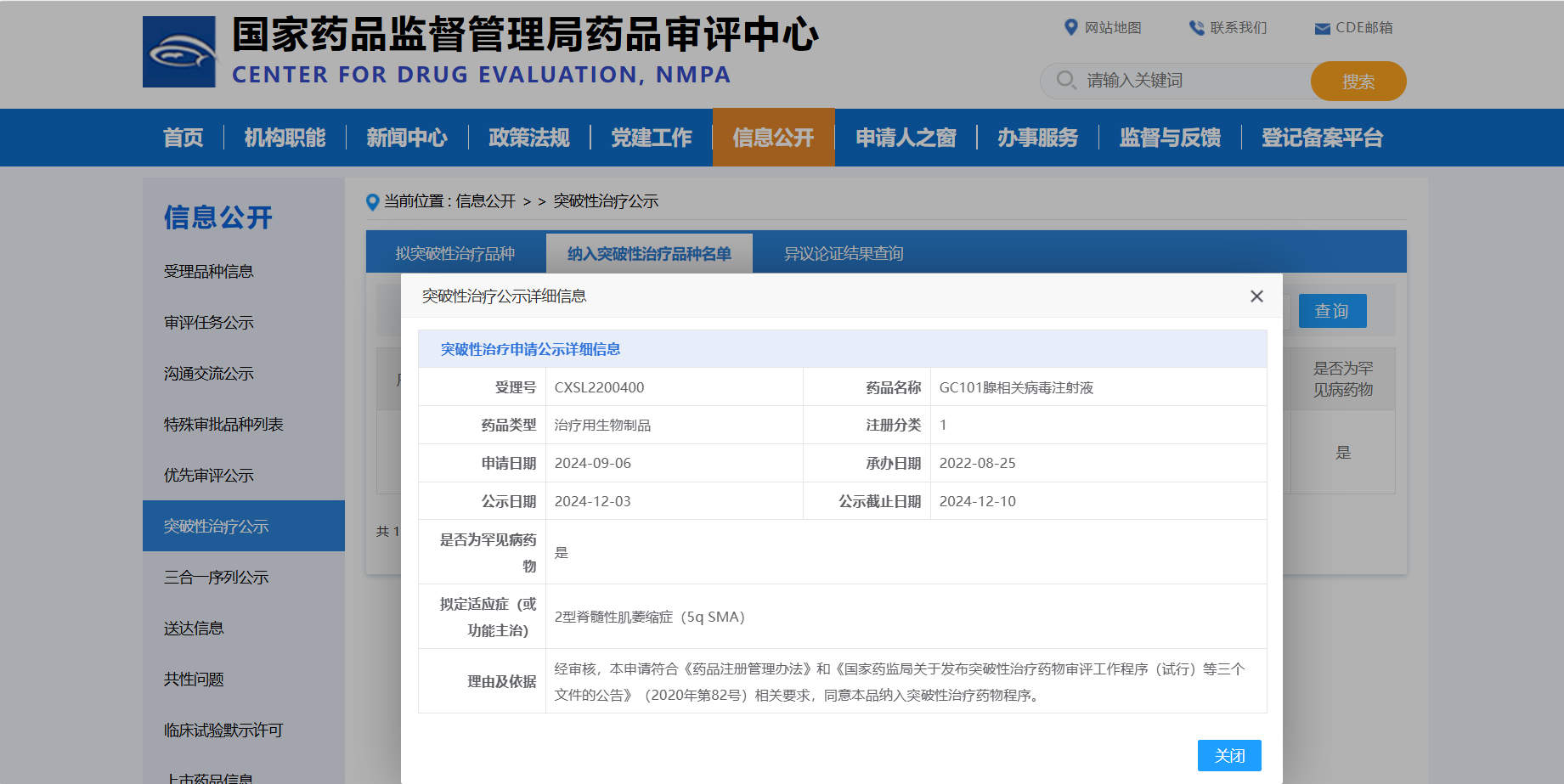
2024年12月11日,随着中国国家药品监督管理局药品审评中心(CDE)公示期落幕,北京锦篮基因科技有限公司自主研发的GC101注射液被正式纳入突破性治疗品种名录。适应症为2型脊髓性肌萎缩症(5q SMA),标志着国内SMA基因治疗取得里程碑式突破。
突破性治疗品种,作为国家药品监管体系中的一项重要机制,专指那些针对严重危及生命或严重影响患者生活质量的疾病,且在当前缺乏有效的治疗手段或相较于现有疗法展现出显著临床优势的创新药物。该认定旨在通过快速审批通道,加速这类药物的研发与上市进程,尽早满足患者的迫切临床需求。
GC101注射液是锦篮基因自主研发的国内首个且唯一可供髓鞘内用药治疗SMA的AAV基因治疗产品,适应症包括1型 SMA、2型 SMA及3型SMA。已开展的临床试验研究数据表明,接受GC101注射液治疗的2型SMA受试者已观察到显著且具突破性疗效,获得了多项新的运动里程碑。相比现有治疗手段,GC101注射液表现出了更显著的治疗效果,实现了“单次治疗,长期疗效”的突破。
GC101注射液纳入突破性治疗品种名单,是锦篮基因治疗药物研发历程中的重要里程碑,将加速药品上市进程,使更多SMA患者能够更早受益于这一先进疗法。此次认定不仅为SMA患者带来福祉,也是对锦篮基因创新研发实力的肯定。未来,锦篮基因将继续秉持“源于需求,益于患者”的初心和方针,致力于基因治疗领域的探索与创新,不断推动医药科技的进步,为更多遗传性疾病患者提供高效、安全的治疗方案,携手共创健康未来。
关于GC101腺相关病毒注射液
GC101腺相关病毒注射液是一种AAV基因疗法,将携带正常SMN1基因表达单元的重组9型腺相关病毒载体(rAAV9),通过鞘内注射方式一次性给药,使SMN1基因在运动神经元细胞表达,从而改善运动神经元等受累细胞的功能,辅以呼吸及运动康复训练,可以改善提高SMA患者呼吸能力及运动能力。针对适应症覆盖1型、2型、3型脊髓性肌萎缩症。已开展的临床试验表现出显著的安全性和有效性,实现了“单次治疗,长期疗效”的突破。
关于脊髓性肌萎缩症
脊髓性肌萎缩症是婴幼儿头号致死性遗传病,是由于运动神经元存活基因1(SMN1)突变导致 SMN 蛋白功能缺陷所致的遗传性神经肌肉病,其致病基因在中国人群中的携带频率约为1/42,新生儿中发病率约为1/10000。1型SMA在出生时或出生数天内出现明显肌无力。至6月龄时症状相当明显。肌张力和反射减弱的患儿存在吸吮、吞咽及呼吸困难。2型SMA患者大部分在青少年时期会丧失独坐能力并瘫痪,患者往往死于呼吸衰竭等并发症;3型SMA患者受长期用药、逐步丧失运动能力等因素影响正常生活。
关于锦篮基因
北京锦篮基因科技有限公司是一家以AAV载体递送技术介导的基因治疗药物开发为核心业务的国家高新技术企业,以推动中国罕见病基因药物从基础走向临床和市场为使命,造福患者及家庭。公司专注于遗传性神经肌肉疾病、遗传代谢疾病、溶酶体疾病以及眼科疾病等领域基因治疗药物开发,并通过推进罕见病基因药物研发和临床应用,更深入认识生命健康,将基因治疗技术及产品从罕见病过渡到慢性病和其它重大疾病的治疗和康复。


